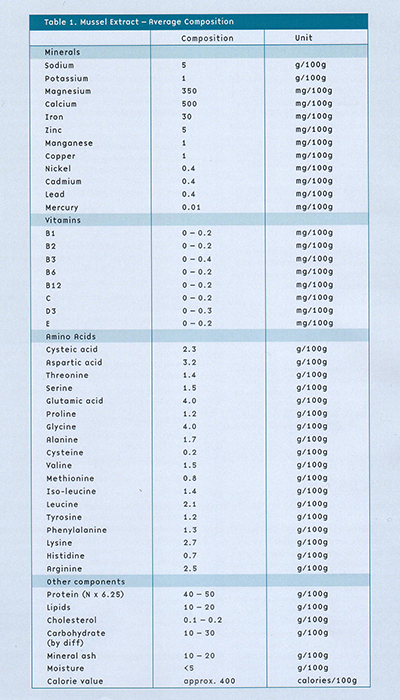
緑イ貝エキス末(GLME)

概要
緑イ貝エキス末(GLME)は、ニュージーランド産緑イ貝(Perna canaliculus)の凍結乾燥抽出物であり、痛みを伴いヒトを衰弱させる関節炎に苦しむ患者に症状の改善をもたらします。
ニュージーランド産緑イ貝には、他の類似の貝類にはないユニークな抗炎症作用があります。それ自体に有益な活性が認められているポリサッカライド、脂質、タンパク質などの多くの成分が同定されていますが、緑イ貝エキス末のどの成分が抗炎症活性を担っているのかは明らかになっていません。様々な科学的研究から、緑イ貝エキス末の治療における有効性は、特定の1つの成分というより、含有される全ての天然成分のコンビネーションによってもたらされると考えられています。
動物やヒトにおける非常に多くの研究から、特に長期投与での緑イ貝エキス末の抗炎症効果が証明されています。緑イ貝エキス末は以下に示す機序を含む様々なメカニズムで、関節炎の炎症過程に影響を及ぼしているように思われます。
- 軟骨の修復のために天然の「成分」を供給します
- プロスタグランジンの生成を抑制し、炎症や軟骨の損傷を軽減します
- 軟骨や結合組織の酵素による損傷を防ぎます
- 免疫応答を調整することにより炎症を抑制します
- 関節炎の炎症部位におけるアポトーシス(細胞のプログラム死)を減少させます
これにより、破壊性疾患の根本的な破壊過程に変化をもたらす可能性があります - 急性期の抗炎症反応を最小限にするため抗ヒスタミン効果を発揮します
緑イ貝エキス末はグリコサミノグリカン類を含んでおり、この成分は関節炎の炎症部位での構造の破壊を軽減することが明らかとなっています。関節炎患者を対象とした適切に設計された臨床試験では、緑イ貝エキス末は痛みのような症状を軽減するだけでなく、関節の機能や可動性を向上させることが示されました。変性関節疾患を患うネコやイヌの関節炎の兆候を改善することも明らかになっており、ペットもまた緑イ貝エキス末の恩恵を受けています。緑イ貝エキス末には重大な副作用がないことが研究で証明されており、その安全性は非常に高いものとなっています。実際、緑イ貝エキス末は関節炎治療に使用される抗炎症薬の有害作用から胃を保護します。
緑イ貝の活性成分と品質を保つため、2種類の工程が採用されました。
- 貝殻から緑イ貝を取り出し、活性分画を素早く抽出する、新しく革新的な緑イ貝処理方法を設計
- 製品の腐敗を防ぎ安定させるために凍結乾燥法を採用
容易に理解できる根拠に基づき、このような方法で緑イ貝を処理すると決定しました。一方、最近の研究では、不適切に設計された製造技術で緑イ貝を加工することは、抗炎症活性を大幅に低下させてしまうことが明らかとなりました。したがって、緑イ貝エキス末は、その活性を保持することのできる独創的な工程によって生産される唯一の緑イ貝抽出製品となります。
含有成分
緑イ貝エキス末はニュージーランド産緑イ貝(Perna canaliculus)から精製された抽出物です。非常に多くの研究から、緑イ貝エキス末には抗炎症活性があり、関節炎のような炎症性疾患の治療に有用であることが示されています。
炎症のプロセスは複雑で、生体内で様々な酵素反応が関与しています。炎症過程の一部では、プロスタグランジン類やロイコトリエン類が生成されます。これらは炎症時に発赤、腫脹、疼痛の原因となる物質です。また別の過程では、アレルギー性炎症反応の強力な誘発物質であるヒスタミンの放出を引き起こします。炎症には生体の免疫システムもまた関与しており、特に好中球と呼ばれる特定の白血球が活性化されます。
緑イ貝エキス末は、抗炎症活性を持つ多くの成分を含有しています。
- フォスフォリピッドリゾレシチン(抗炎症、抗ヒスタミン)1
- ポリサッカライドグリコーゲン(炎症部位における免疫活性化の抑制)2,3
- タンパク質分画(抗炎症)4,5
- 脂質分画(抗炎症、胃壁の保護)6
緑イ貝エキス末の治療効果は、多くの成分が全て同時に作用することで得られる相補的な効果と考えられています4。緑イ貝エキス末のグリコーゲン分画の抗炎症活性は緑イ貝特有のものであり、紫イ貝や他の二枚貝からのグリコーゲンにはこの活性が無いことも示されています3。
さらに、緑イ貝エキス末の4~6%はグリコサミノグリカン類であり、これは関節の軟骨の修復に重要な成分です7。また、関節を滑らかにする滑液の成分であるヒアルロン酸も含有しています。212名の変形性関節炎患者を評価した大規模臨床試験では、グルコサミンは関節の変形を抑制し、症状の緩和をもたらしました8。グルコサミンは、緑イ貝エキス末に含有されるグルコサミノグリカンの前駆体です。このように、緑イ貝エキス末は炎症を抑制し炎症関節の構造の変性を防ぐことで、関節炎患者の痛みと硬直を緩和する治療を提供しています。
作用機序と期待される効果
緑イ貝エキス末は炎症関節での炎症を抑制し、損傷した軟骨の修復のための材料を供給する、多くの生物学的に活性のある成分を含有しています。
軟骨は骨の末端を覆う滑らかなカバー(図1)であり、主に2つの役割を持っています。
- 関節が動く際、骨がもう1つの骨の上を滑るように動くことができるよう表面を滑らかに保ちます
- 関節に負荷がかかった際、衝撃吸収剤として働きます
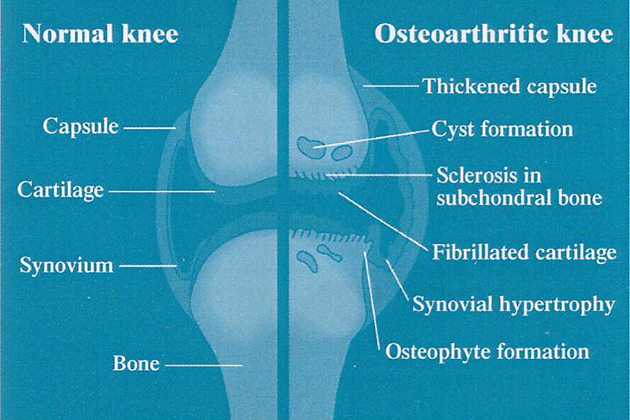
軟骨は主に、コラーゲン、プロテオグリカン類(タンパク質とグルコサミノグリカン類またはGAGsの複合体)、水分、軟骨細胞から成り立っています。体内の全ての組織と同様に、軟骨も絶えず壊れては再生しています。しかしながら、炎症の起きている関節では、炎症の過程が軟骨の破壊を促進し、様々な症状や関節炎由来の関節の変形をもたらします。そこで、緑イ貝エキス末は以下の機序によりこの過程に対抗します7。
- 最適な軟骨合成を維持するための十分な原料(GAGs)を供給します
- プロスタグランジンの生成を抑制するため、炎症や軟骨の損傷を軽減します
- コンドロイチン硫酸を含有しており、軟骨の異化性サイトカインによる変性を抑制します
- 免疫応答を調整することにより炎症を抑制します
- 関節炎の炎症部位におけるアポトーシス(細胞のプログラム死)を減少させます
これにより、破壊性疾患の根本的な破壊過程に変化をもたらす可能性があります - 急性期の抗炎症反応を最小限にするため抗ヒスタミン効果を発揮します
抗炎症作用
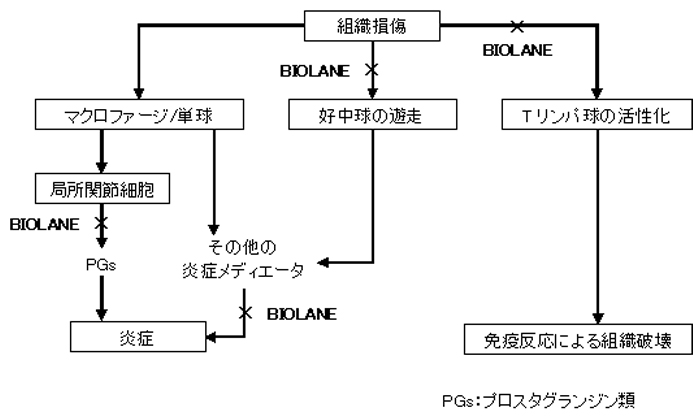
多くの研究から、緑イ貝エキス末が関節炎の動物モデル3,5-7,9-13や関節炎に苦しむ人々4,7,13,14において、直接炎症過程を抑制することが示されています。この抗炎症活性にはさまざまな作用機序が関与していることが分かっています。炎症関節で観察される炎症のプロセスは複雑であり、局所炎症反応と慢性的な(長期にわたる)免疫反応が関与しています(図2)。重要なことは、緑イ貝エキス末はこれらの2種類の反応を調整するということです。
1. 炎症性のプロスタグランジン類とヒスタミンの産生を抑制
GLMEは炎症性のプロスタグランジン類15とヒスタミン3の産生を抑制します。これらの組織ホルモンの産生を抑制することにより、炎症部位でプロスタグランジン類やヒスタミンによって引き起こされる腫脹と痛みを軽減します。
2. 炎症部位への白血球の遊走を抑制
緑イ貝エキス末は炎症部位への白血球(好中球2Tリンパ球16)の遊走を抑制します。好中球は、炎症性メディエーターの放出を刺激し炎症反応を助長し、Tリンパ球は関節リウマチに認められる組織破壊の重要なメディエーターであることが知られています。
胃保護作用
抗炎症剤において重要なのは、効果的であるということだけでなく、摂取するヒトにとって安全でなくてはなりません。関節炎の患者の多くは年配の方で、加齢による組織機能の低下のため、薬剤の副作用発現のリスクは高くなります。関節炎の治療に使用される薬剤は、深刻な副作用を引き起こす可能性があります。非ステロイド性抗炎症剤(NSAIDs)は、関節炎の治療で最も一般的に使用される薬剤ですが、胃内壁の潰瘍や出血を引き起こす危険があります。アメリカではNSAIDsの使用による重症胃出血により、毎年17000人が亡くなっていると報告されています。
初期の動物における研究では、緑イ貝エキス末が胃の内壁に潰瘍の形成を引き起こさなかったというだけでなく、実際にはNSAIDsの有害作用から胃を保護したということが証明されています6。緑イ貝エキス末の脂質分画は、胃保護作用を持つ成分として同定され、さらにこれらの分画は穏やかな抗炎症作用を持つことも示されています。この発見は、関節炎の患者が通常の薬物治療へ緑イ貝エキス末を追加投与しても問題ないということを示した貴重な発見です。緑イ貝エキス末はこれらの薬物の有害な作用から胃内壁を保護するのです。
緑イ貝エキス末がシクロオキシゲナーゼ2の選択的な阻害剤であることも示されています17。細胞膜リン脂質を炎症性プロスタグランジン類に変換させるシクロオキシゲナーゼという酵素の活性を阻害することは、抗炎症過程において重要です。しかしながら、シクロオキシゲナーゼにはCOX-1とCOX-2という2種類のアイソザイムが存在し、COX-1は体に重要な酵素で健康や消化機能、腎機能、血小板凝集を正常に維持するという役割を担っています。一方、COX-2は炎症を助長させる反応の中で誘導されます26。緑イ貝エキス末がCOX-1活性を阻害せずにCOX-2活性のみを阻害することができるということ、つまりCOX-2選択性であるということは、この製品には胃を傷害する効果は全く無く、腎機能や血小板凝集にも影響を与えないことを意味しています。
このような特徴は、通常使用される非ステロイド性抗炎症剤(NSAIDs)やグルコサミン、コンドロイチン硫酸のような他の抗炎症治療剤と比較し、緑イ貝エキス末を独創的なものにしています。NSAIDsの選択性のなさによる胃、腎、血小板などへの副作用はよく知られています。また、グルコサミンやコンドロイチン硫酸についても、2002年5月のUS Health Sciences Institute e-Alertでは、前立腺がんの治療を受けている患者において、これらを含有する健康補助食品の副作用が報告されています19。
また、細胞膜リン脂質を炎症に関与する気管支収縮性のロイコトリエン類へ変換させる5リポキシゲナーゼ酵素を、緑イ貝エキス末の脂質成分が阻害することも証明されています20。この阻害作用から、緑イ貝エキス末は5リポキシゲナーゼ活性を持つ製品を摂取することによる長期間の組織損傷を予防または軽減できることを意味しています28。
緑イ貝エキス末のMMP阻害作用
マトリックスメタロプロテアーゼ(Matrix metalloproteinase、MMP)はメタロプロテアーゼ (活性中心に金属イオンが配座しているタンパク質分解酵素の総称)の一群であり、MMPの活性中心には亜鉛イオン(Zn2+)が含まれます。MMPファミリーに属する一群は現在、コラゲナーゼ(MMP-1、-8、および-13)、ゼラチナーゼ(MMP-2および9)、ストロメライシン(MMP-3および10)、マトリライシン(MMP-7および26)、および膜結合型MMP(MMP-14〜17および24)に分類することができ、25以上の種類に及びます。
MMPは、個体発生、血管新生、創傷治癒を含む多くの正常な生物学的過程ならびに炎症、癌、組織破壊などの病理学的過程において重要です。MMPは細胞外マトリックス(ECM)の構成成分の、全てではないにしても殆どを切断し、多くの組織・器官の分解およびリモデリングに関与しています。
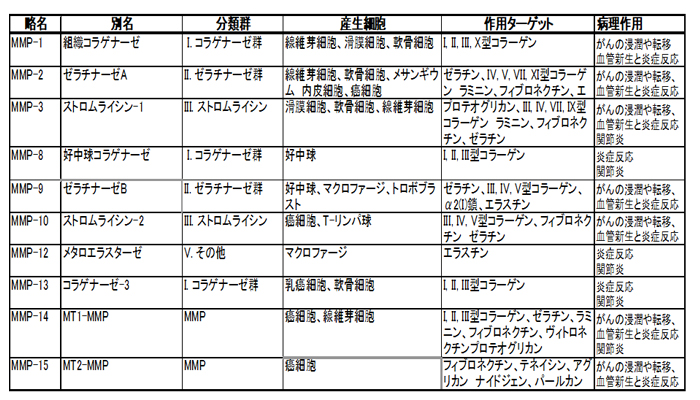
MMP1
間質コラゲナーゼとも呼ばれ、 線維性コラーゲンを切断し、間質コラーゲン、タイプI、II、IIIコラーゲンを分解します。MMP3
ストロメライシンともいい、 細胞外エンドペプチダーゼ、プロテオグリカン、フィブロネクチン、タイプIII IV IXコラーゲンを分解しプロコラゲナーゼを活性化します。MMP8またはコラゲナーゼ2
3重らせん構造のタイプI、II、IIIコラーゲンを分解します。MMP13またはコラゲナーゼ3
骨格組織に見られる細胞外マトリックスの分解において生理学的役割を果たす分泌型MMPです。MMPsはほとんどすべての細胞外マトリックスを分解することができますが、癌において特に重要なのは、基底膜の主要なタンパク質であるタイプIVコラーゲンのMMP2とMMP9による分解です。MMPによって誘発されたヘパリン結合上皮の増殖因子、インスリン様増殖因子、および線維芽細胞増殖因子の細胞表面(分散)からの放出は細胞増殖を増加します。一方、 MMPによって誘発されたECMの分解と活性化後できたTGFßは細胞増殖を抑制します。MMPによるFasリガントの細胞表面から脱落は、細胞生存を機能アップするか、または調節することができます。また、MMP14とMMP1は癌細胞の遊走機能をアップすることが示されました。
軟骨の退行性変性は、アグリカナーゼ(ADAMTS)やマトリックスメタロプロテアーゼ(MMP)といったマトリックス分解酵素の放出による多段階の変性プロセスです。インターロイキン-1(IL-1)とIL-17などのサイトカインはマトリックス分子からマトリックス分解酵素までの軟骨細胞による合成パターンをスイッチさせます。さらに、線維芽細胞はマトリックス分解酵素を作り出し、腫瘍壊死因子(TNF)とIL-1などのサイトカインによって刺激されると軟骨に侵入し始めます。軟骨細胞死は、軟骨損傷の別の特徴で、軟骨細胞脱落による空胞に通じるということであり、軟骨からマトリックスを補給する能力を減少させます。
また光老化は、太陽の紫外線(UVR)照射への長期被曝に続いて起こった皮膚損害、皮膚肥厚、目の下の粗いしわ、および老年スポットによって特徴付けられます。皮膚へのUVR長期被曝により一連の生化学の連鎖反応が起こり、皮膚細胞の正常な機能が失われ、皮膚細胞は生から死のモードに誘導されます。そして炎症を起こし、免疫細胞を活性化され、異物から自身を守る生体の防御機構を立ち上げます。更に細胞死、皮膚色素の合成を誘導し、そして、マトリックスメタロプロテアーゼ(MMP)という酵素を産生・誘導します。これらのMMPは皮膚マトリックスを崩し、皮膚にたるみとしわが出来ます。
緑イ貝エキス末によるMMP活性阻害に関してIn vitro Enzyme Immuno assayを用いた研究がオークランドにある独立研究機関によって行われ、緑イ貝エキス末は14種もの広範囲におよぶMMP活性を効果的に抑制する事が明らかになっています。特にコラーゲンやエラスチンの分解に関与するMMP-1、MMP-3、MMP-8、MMP-13に対しては顕著な阻害活性を示しました。
研究情報
緑イ貝エキス末は、関節炎患者やヒトの変形性関節炎に病態が非常に類似する変形性の関節疾患を患う動物で、多くの臨床試験が行われています。これらの研究の結果は良好であり、緑イ貝エキス末が顕著に関節炎の症状を軽減することが証明されています。
関節性リウマチと変形性関節症における効果
緑イ貝エキス末の大規模臨床試験では、関節性リウマチ(RA)と変形性関節症(OA)の患者、計66名においてその効果が評価されました13。患者は緑イ貝エキス末群(1日1050mg摂取)(n=33)とプラセボ群(n=33)に無作為に分類され、それぞれ3ヵ月間投与されました。その後、全患者に緑イ貝エキス末をさらに3ヶ月間投与しました。重要なのは、本試験は2重盲検法で計画されており、患者も医師も各患者がどちらの群に属しているのかは分からなかったということです。この試験法は治療効果の評価に先入観を持たないようにするために採用されました。
試験期間のはじめの3ヵ月間(2重盲検時)では、緑イ貝エキス末群の方がプラセボ群より、多くの患者において臨床的な改善が認められています。(図3)
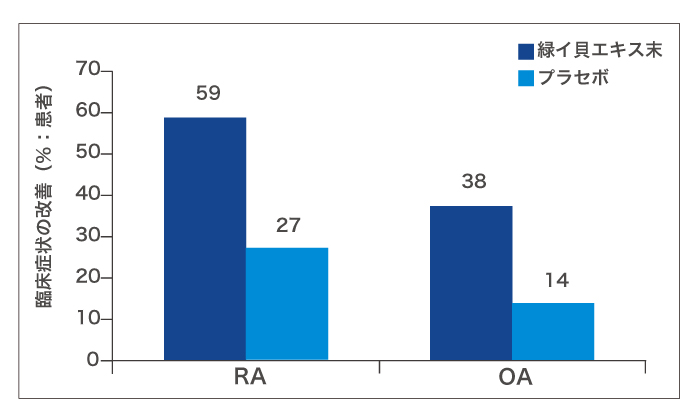
その後の3ヵ月間では全ての患者が緑イ貝エキス末を摂取し、さらに6名のRA患者と6名のOA患者において改善が認められました。したがって、6ヶ月間における全体的な改善は、RA群67.9%、OA群39.5%でした。効果の認められた患者では、関節機能の改善、痛みの軽減、可動性の改善か得られています。さらに、試験開始時に夜間痛を訴えていた患者の37%では、GLME治療期間中に夜間痛が消失しました。
この素晴らしい結果は、フランス人研究者らによって実施された、53名の膝関節炎患者における研究の発見によっても裏付けられています14。彼らは、片方の関節のみに関節炎を患う患者を採用し、関節炎に伴う結果をゆがめる可能性のある要因を排除しました。
Gibsonらによる研究同様、二重盲検試験の方法に従い、患者はプラセボ群と緑イ貝エキス末群に分類されました(カプセルの外観は全く同一)。患者は6ヶ月後、以下の項目について変化を評価されました。
- 機能的障害
- 痛み
- 早朝時のこわばりの継続時間
- 関節の可動性の指標
- 最長歩行距離
- 臨床的改善の患者・医師による評価
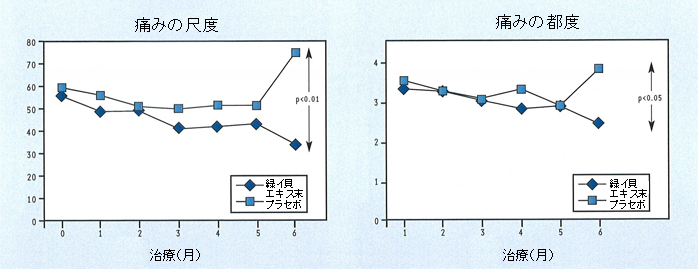
6ヶ月後の試験終了時、緑イ貝エキス末を摂取していた患者ではプラセボ群と比較して、痛み、関節機能、患者・医師による効果の評価において統計学的に有意な改善が認められました(図4)。他の評価項目においても緑イ貝エキス末群がプラセボ群より有効ではありましたが、統計学的有意差は認められませんでした。
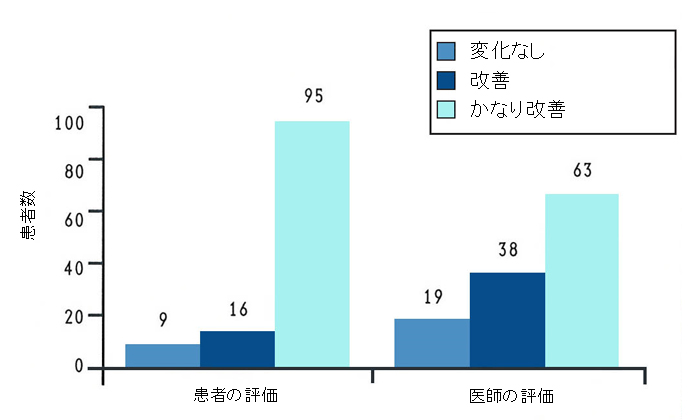
これらの結果は、アメリカで行われた膝関節炎の患者120名での長期投与試験により支持されています7。この研究では、プラセボコントロールは設けておらず、全ての患者は最低1年間緑イ貝エキス末を服用しました。12ヶ月間の治療の後、ほとんどの患者は程度の差はあれ、改善したと報告しています(図5)。かなり多くの患者で、非ステロイド性抗炎症薬の服用を50%まで減量することができました。この試験で最も著名な改善を示したのは、軽度から中等度の患者でした。
また、関節腔の狭小は変形性関節症患者によく見られるX線所見です。図6は緑イ貝エキス末服用前と服用開始後15ヶ月の変形性関節炎患者の膝のX線写真です。これらのX線写真から、緑イ貝エキス末は変形性関節炎患者の膝関節の狭小を改善することが視覚的にはっきりと分かります。
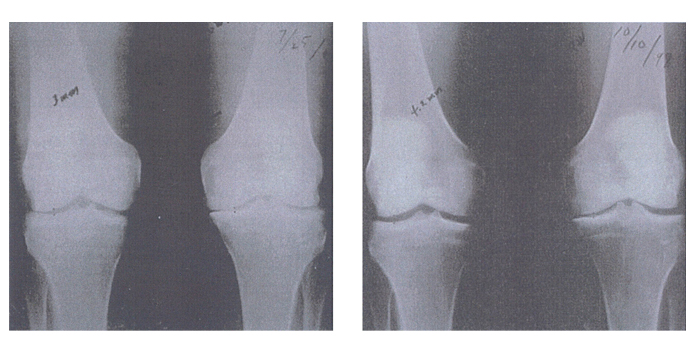
[Kendall R, et al. Townsend Letter for Doctores and Patients 2000; Jul: 98-11]
緑イ貝エキス末全ての研究でこのような劇的な結果が示されているわけではありません21-24。しかし、結果の思わしくなかった研究には、実験結果の正当性を損なう実験的な不備があったのも事実です。たとえば、HightonとMcArthurによる研究では患者数が6名と少なく、さらに観察期間も長期投与が必要となる疾患において有効な結果を出すには短すぎる6週間でした24。
緑イ貝エキス末の犬や猫への効果
関節炎治療における緑イ貝エキス末の有効性は、ヒト関節炎に病理学的に類似する変形性関節炎(DJD)を患うネコやイヌにおいて、緑イ貝エキス末が関節疾患の兆候を減少させたという研究10,12,25からも支持されています。ある実験では、様々な炎症性関節疾患を患うイヌ43頭とネコ6頭に数週間緑イ貝エキス末を投与しました。治療終了時、93%の動物に治療効果が認められ、そのうち37%では著明な改善が認められています12。
他の研究では、二重盲検法でDJDのイヌ81頭を緑イ貝エキス末群とプラセボ群に無作為に分類し、7週間治療を行いました10。実験終了時、緑イ貝エキス末投与群では高い割合で臨床的な病態の統計学的に有意な改善が認められました(緑イ貝エキス末群66.7%、プラセボ群40.5%;p=0.018)。その後、全てのイヌに緑イ貝エキス末をさらに56日間、非盲検で投与しました。122日間の治療終了時、改善を示した動物の割合は78.4%まで上昇しましたが、この改善の増加は、ペットが緑イ貝エキス末を服用しているという飼い主の認識に一部起因している可能性もあり、またさらに長期間投与したことにより臨床的な効果が上昇した可能性もあります。
これは、他の無作為二重盲検試験(飼い主はペットが緑イ貝エキス末を摂取していることを知らない)の結果によっても裏付けられています25。この実験では、イヌは無作為に乾燥ドッグフード群と緑イ貝エキス末含有乾燥ドッグフード群に分類されました。獣医師は、痛み、腫脹、関節摩擦音、可動領域の減少などの指標に基づき、関節炎の重症度をイヌごとにスコア化しました。6週間後、プラセボ群と比較し緑イ貝エキス末投与群では関節炎のスコアの著しい改善が認められ、その変化は特に痛みと関節の腫脹のスコアにおいて顕著でした25。緑イ貝エキス末を食餌に添加するのではなくサプリメントとして投与した場合、さらに著しい効果が得られる可能性があると期待されています。
軟骨組織損傷からの回復のスピード
緑イ貝エキス末はスポーツ傷害による軟組織損傷からの回復を加速しました26。二重盲検法で20名の男性のサイクリストを緑イ貝エキス末群とプラセボ群に無作為に分類し、全サイクリストは、筋肉の損傷を誘発するため40kmのタイムトライアルの後、ドロップジャンプを行いました。緑イ貝エキス末投与群では、筋肉損傷後2週間以内にピークパワーが回復し、回復程度も優れている傾向にありました。この研究から、緑イ貝エキス末の抗炎症効果は健常人の軟組織損傷後の回復も助けるということが示唆されました。
副作用・ご注意
動物実験では、緑イ貝エキス末には通常摂取すべき量より多い高用量投与において毒性が無かったことが証明されています27。緑イ貝エキス末は高用量でも安全というだけでなく、妊娠した動物に投与した際、胎児の成長に有害な作用はなかったことから、催奇形性作用もないことが明らかとなっています。しかしながら、原料が貝由来の為、魚介類にアレルギーをお持ちの方は念のため、医師薬剤師へご相談ください。
引用文献
- Kosuge T, Tsuji K, Ishida H, Yamaguchi T. Isolation of an anti-histaminic substance from green-lipped mussel (Perna canaliculus). Chem Pharm Bull 1986; 34 (11):4825-8
- Miller TE, Dodd J, Ormrod DJ, Geddes R. Anti-inflammatory activity of glycogen extracted from Perna canaliculus (NZ green-lipped mussel). Agents Actions 1993; 38 (Special Conference issue):C139-42
- Knaus UG, Tubar A, Wagner H. Pharmacological properties of glycogens: anti-complementary and anti-inflammatory action of mussel glycogen (Perna canaliculus). Department of Immunology Imm2, Scripps Clinic and Research Foundation, La Jolla, California, USA. Also Universities of Trieste, Italy and Munich, Germany.
- Billard H. Extract of Perna Canaliculus (New Zealand green-lipped mussel) in rheumatology. La Gazette Medicale 1985;92 (7):1-5
- Couch RAF, Ormrod DJ, Miller TE, Watkins WB. Anti-inflammatory activity in fractionated extracts of green-lipped mussel. NZ Med J 1982;95 (720):803-6
- Rainsford KD, Whitehouse MW. Gastroprotective and anti-inflammatory properties of green lipped mussel (Perna canaliculus) preparation. Arzneim Forsch/Drug Res 1980; 30 (11):2128-32
- Kendall RV, Lawson JW, Hurley LA. New research and a clinical report on the use of Perna canaliculus in the management of arthritis. Townsend Letter for Doctors & Patients 2000; 204:99-111
- Reginster JY, Deroisy R, Rovati LC, et al. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomized, placebo-controlled clinical trial. Lancet 2001; 357:251-6
- Miller TE, Ormrod D. The anti-inflammatory activity of Perna canaliculus (NZ green lipped mussel). NZ Med J 1980; 92 (667): 187-93
- Ankenbauer-Perkins K, Slacek B, Alexander A et al. Final report on the efficacy of green-lipped mussel extract in the management of degenerative joint disease in dogs. Study no. AHSC-75353. September 1999. Animal Health Sciences Center, Massey University, Palmerston North, New Zealand.
- Daum A. The influence of Seatone (RO 49-0282/100), and fractions of Seatone, on the established adjuvant arthritis of the rat. Roche Laboratories Report, Switzerland 1976
- 織間博光, 藤田道郎, 大村知之, 桐原信之, 島田健次郎. 犬および猫の関節疾患に対する緑イ貝抽出物の効果. 小動物臨床 1998 Vol.17 No.1
- Gibson RG, Gibson SLM, Conway V, et al. Perna canaliculus in the treatment of arthritis. Practitioner 1980; 224; 955-60
- Audeval B, Bouchacouet P. Double blind, placebo controlled study of the mussel Perna canaliculus (New Zealand Green-lipped mussel) in gonarthritis (arthritis of the knee). La Gazette Medicale 1986; 93 (38): 111-5
- Miller T, Wu H. In vivo evidence for prostaglandin inhibitory in New Zealand green-lipped mussel extract. NZ Med J 1984; 97: 355-7
- Miller TE, Ormrod DJ, Findon G. Evaluation of the effect of Seatone administration on cell-mediated immune mechanisms determined using in vitro and in vivo analysis of T lymphocyte function. Private study in the Department of Medicine, University of Auckland 1984
- Personal communication from researchers at the Wellington Clinical School,. University of Otago School of Medicine, New Zealand. Results of COX-2 Specificity Study, 2002
- Smith WL, Meade EA, DeWitt DL. Interactions of PGH synthase isozymes-1 and –2 with NSAIDs. Ann NY Acad Sci 1994; 744:50-7
- A Emelyanov, G Fedoseev, O Krasnoschekova, A Abulimity, T Trendeleva, P J Barnes. Health Sciences Institute e-Alert. Treatment of asthma with lipid extract of New Zealand green-lipped mussel: a randomised clinical trial. Eur Respir J 2002 Sep; 20(3): 596-600.
- Personal communication from researchers at the Department of Medicine, University of Adelaide, Australia. Green-Lipped Mussel Lipids and the inhibition of 5-Lipoxygenase,1998
- Lakin JG, Capell HA, Sturrock RD. Seatone in rheumatoid arthritis: a six-month placebo-controlled study. Ann Rheum Dis 1985; 44:199-201
- Caughey DE, Grigor RR, Caughey EB, et al. Perna canaliculus in the treatment of rheumatoid arthritis. Eur J Rheum Inflam 1983; 6:197-200
- Huskisson EC, Scott J, Bryans R. Seatone is ineffective in rheumatoid arthritis. Br Med J 1981; 282:1358-9
- Highton TC, McArthur AW. Pilot study on the effect of New Zealand green mussel on rheumatoid arthritis. NZ Med J 1975; Mar 12:261-2
- Bui LM, Bierer TL. Influence of green lipped mussels (Perna canaliculus) in alleviating signs of arthritis in dogs. Veterin Ther 2001; 2 (2): 101-11
- Lambert M, Semark A, Grobler L. The ergogenic properties of Seatone. Research Report by MRC/UCT Bioenergetics of Exercise Research Unit, UCT Medical School, Sport Science Institute of South Africa, 31st August 1998
- Data on file. Unpublished research conducted at the University of Auckland, New Zealand in 1979 and 1981
- Bertolini A, Ottani A, Sandrini M. Dual acting anti-inflammatory drugs: a reappraisal. Pharmacol Res 2001; 44 (6): 437-50
参考文献
- Effect of a diet enriched with green-lipped mussel on pain behavior and functioning in dogs with clinical osteoarthritis
- A randomised, double-blinded, placebo-controlled study on the efficacy of a unique extract of green-lipped mussel (Perna canaliculus) in horses with chronic fetlock lameness attributed to osteoarthritis
- Evaluating Complementary Therapies for Canine Osteoarthritis Part I: Green-lipped Mussel (Perna canaliculus)
- Clinical efficacy and tolerance of an extract of green-lipped mussel (Perna canaliculus) in dogs presumptively diagnosed with degenerative joint disease
- Omega 3 fatty acids: biological activity and effects on human health
- Vascular mechanisms in osteoarthritis: rationale for treatment with a marine-based complementary medicine
- Improvement of Arthritic Signs in Dogs Fed Green-Lipped Mussel (Perna canaliculus)
- Treatment of asthma with lipid extract of New Zealand green-lipped mussel: a randomised clinical trial
- Influence of Green Lipped Mussels (Perna canaliculus) in Alleviating Signs of Arthritis in Dogs
- Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial
- New Research and a Clinical Report on the Use of Perna Canaliculus in the Management of Arthritis
- 犬および猫の関節疾患に対する緑イ貝抽出物の効果
- Anti-inflammatory activity of glycogen extracted from Perna canaliculus (NZ green-lipped mussel)
- Double blind, placebo controlled study of the mussel Perna canaliculus (New Zealand Green-lipped mussel) in gonarthritis (arthritis of the knee)
- Isolation of an anti-histaminic substance from green-lipped mussel (Perna canaliculus)
- Seatone in rheumatoid arthritis: a six-month placebo-controlled study
- In vivo evidence for prostaglandin inhibitory activity in New Zealand green-lipped mussel extract
- Perna canaliculus in the treatment of rheumatoid arthritis
- Anti-inflammatory activity in fractionated extracts of the green-lipped mussel
- Gastroprotective and anti-inflammatory properties of green lipped mussel (Perna canaliculus) preparation
- Perna canaliculus in the treatment of arthritis
- The anti-inflammatory activity of Perna canaliculus(NZ green lipped mussel)
